Vorlesung Anorganische Strukturchemie
3. Strukturchemie von Metallen und Legierungen
3.2. Kugelpackungen, elementare Metalle
Fast alle Metalle kristallisieren in einem der drei folgenden Strukturtypen:
- kubisch innenzentrierte Packung = body-centered cubic = b.c.c.
- hexagonal dichteste Kugelpackung = hexagonal close packed = h.c.p.
- kubisch dichteste Kugelpackung = kubisch flächenzentrierte Packung =
face centered cubic = f.c.c.
Die Verteilung der Strukturtypen im Periodensystem ist
der Übersicht in Abbildung 3.2.1. zu entnehmen.
Abb. 3.2.1. Strukturen der
metallischen Elemente ‣SVG
Die Abfolge der Strukturtypen ist nur bedingt über die elektronischen
Strukturen erklärbar (Details dazu siehe
Kap. 2.3. der Vorlesung Intermetallische Phasen).
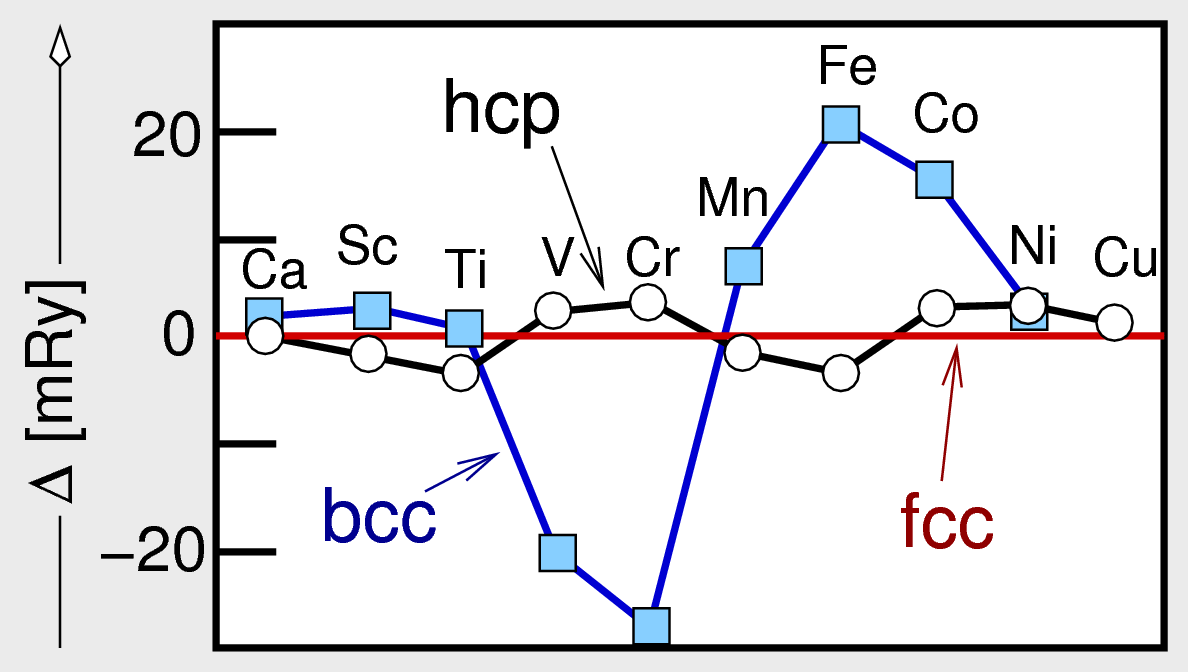
Aus dem Vergleich der berechneten Energien für die unterschiedlichen Strukturtypen
- in Abb. 3.2.2. hier relativ zur f.c.c.-Struktur (rote Linie) aufgetragen - ergibt sich die
im Periodensystem beobachtete Phasenfolge:
f.c.c. (Ca) ⟶ h.c.p. (Sc, Ti) ⟶ b.c.c. (V, Cr) ⟶ f.c.c. (Ni, Cu)
Ausnahmen von dieser Folge finden sich bei den magnetischen Elementen Fe und Co, die entgegen der
Voraussage im b.c.c.-Typ kristallisieren. Die vollständige und korrekte Berechnung
unter Einbezug der magnetischen Wechselwirkungen liefert heute auch die korrekte Phasenfolge.
Abb. 3.2.2. Berechnete Stabilitäten ausgewählter Metalle
‣SVG
Zunächst soll eine kurze Wiederholung der
Strukturchemie der drei einfachen Metallpackungen
gegeben werden.
Die drei Strukturtypen bauen auf zwei Anordnungen von Kugeln in der Ebene auf:
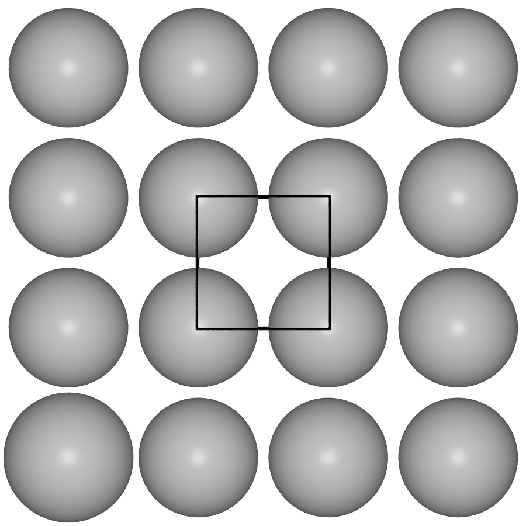
- I. Einer quadratisch dichten Packung von Kugeln in der Ebene
im Fall der b.c.c.-Struktur.
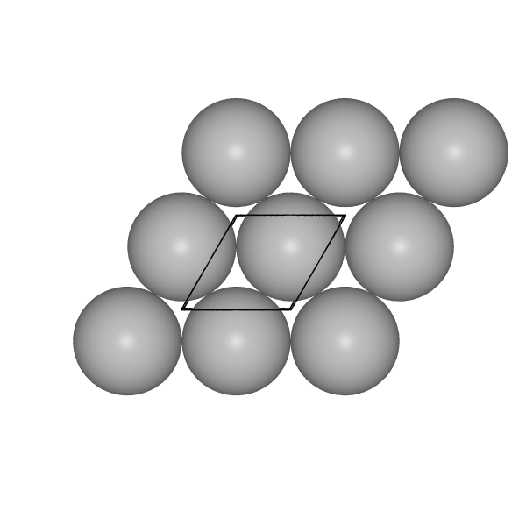
- II. Einer hexagonal dichtesten Packung von Kugeln in der Ebene
im Fall der h.c.p.- und der f.c.c-Struktur.
Je nach Stapelfolge ergeben sich die drei Basispackungen:
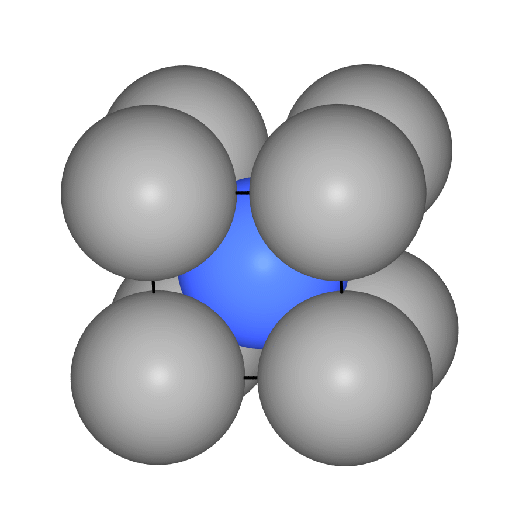
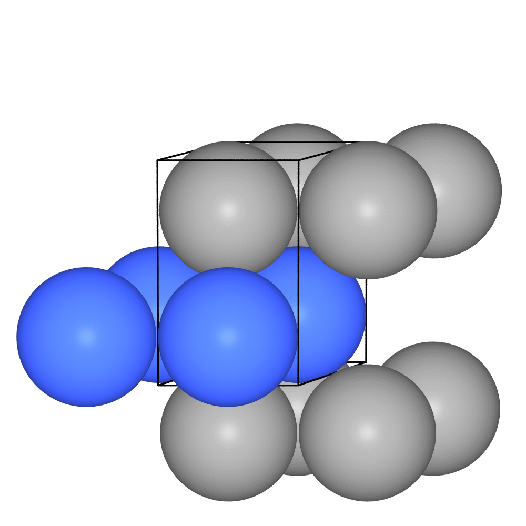
- b.c.c. oder kubisch innenzentriert oder W-Typ:
Basis der kubisch innenzentrieten Metallpackung sind quadratische Schichten,
die in der Folge A-B-A gestapelt sind.
Die Kugeln berühren sich innerhalb der Schichten nicht, die Kontakte der Kugeln
verlaufen vielmehr auf den Würfeldiagonalen.
Das Koordinationspolyeder um die Atome ist ein Würfel (CN 8, Atomabstand
0.866*Gitterkonstante a) und in etwas weiterer Entfernung (Atomabstand 1*a) ein weiteres
Oktaeder, so daß insgesamt die Koordinationszahl 8+6 folgt. Die Raumerfüllung
einer solchen Anordnung von Kugeln beträgt 68.02 %.
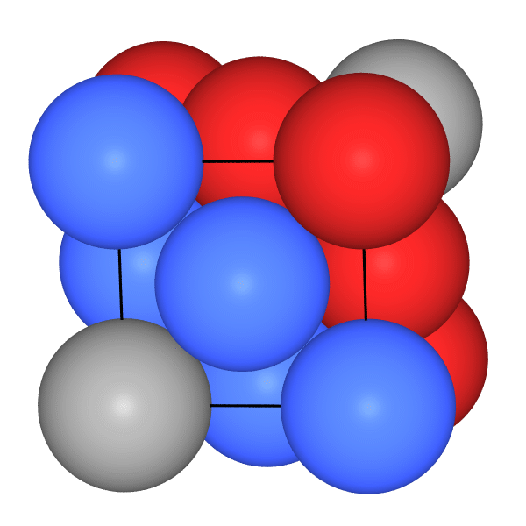
Die folgenden VRMLs zeigen einen Ausschnitt
aus der Gesamtstruktur, ein zusammengesetztes
Koordinationspolyeder (CN: 8 (Würfel, rot) + 6 (Oktaeder, grau) in
der Darstellung mit Kugeln
bzw. in der Polyederdarstellung
und ein VRML2 des Übergangs von der
Kugel- zur Polyederdarstellung.
- Die beiden die nächsten Metallstrukturen, die hexagonal und die
kubisch dichte Packungen, sind echte dichteste Kugelpackungen
im Raum. (Der Beweis hiervon gelang den Mathematikern erst kürzlich!),
d.h. es handelt sich um diejenigen Anordnungen identischer Kugeln mit der
maximalen Dichte und der maximalen Raumerfüllung von 74.05 %.
Basis der beiden Strukturen (und vieler Varianten) ist die
Packung von Kugeln in einer dichten Schicht in der Ebene.
Diese Schichten sind im Prinzip in beliebiger Stapelfolgen denkbar.
Am wichtigsten sind:
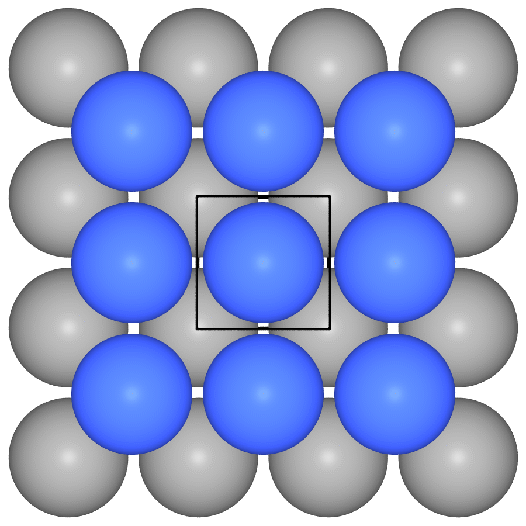
- f.c.c. oder kubisch flächenzentriert
oder kubisch dichteste Kugelpackung oder Cu-Typ:
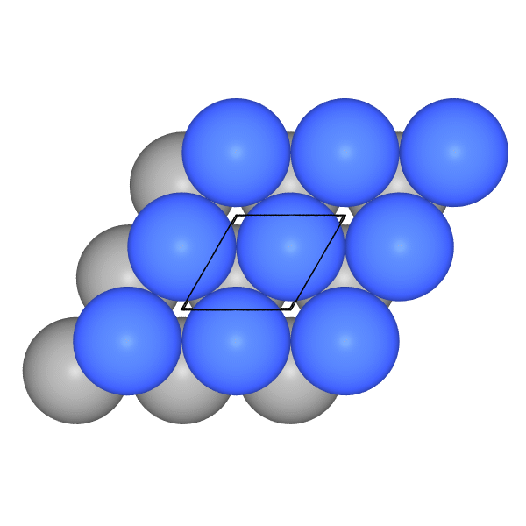
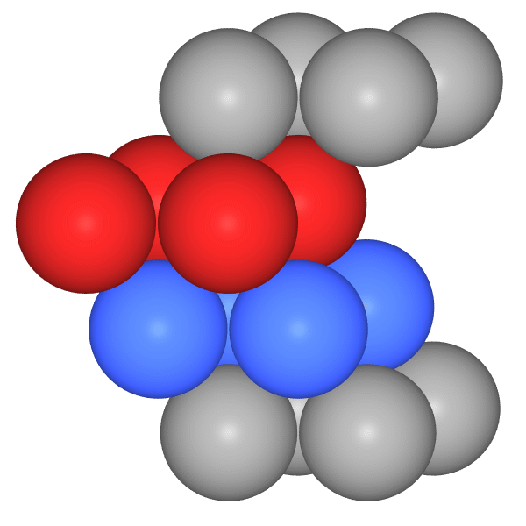
Die Stapelfolge der Schichten ist |:A-B-C-:|. Die dichtesten Schichten
verlaufen senkrecht zu allen Raumdiagonalen. Als Koordinationspolyeder
ergibt sich ein Kuboktaeder (CN 12). Hierzu einige Bilderserien:
- Aufbau der Gesamtpackung:
In Abbildung 1 eine
dichteste Kugelschicht in der Ebene (rot) und die ersten Atome der folgenden
Schicht B (gelb). In 2
kommt die 3. Schicht (C, in blau), die (senkrecht zur Schichtebene)
weder genau über A noch genau über B liegt.
Die vierte Schicht (eine Kugel und
komplette Schicht)
ist wieder identisch mit der ersten (A-B-C-A-Stapelung).
Diese Stapelfolge liegt senkrecht zu allen Raumdiagonalen der Zelle vor
( hier zum Probieren).
- Ausschnitte aus der Gesamtstruktur und das Koordinationspolyeder:
- h.c.p. oder hexagonal dichteste Kugelpackung oder Mg-Typ:
Hier sind die dichten Schichten in der Stapelfolge |:A-B-:| angeordnet, das
Koordinationspolyeder (CN 12) ist ein Antikuboktaeder. Auch hierzu eine Bilderserie:
Die Tabelle 3.1.1. enthält die Angaben zu den Kristallstrukturen:
Tab. 3.2.1. Basisstrukturen der Metalle
In seltenen Fällen finden sich auch andere Stapelfolgen, z.B. gibt es bei den
Lanthanoiden auch Vertreter mit einer sogenannten doppelt-hexagonalen Stapelung,
der Stapelfolge |:A-B-A-C:|.
Viele Metalle sind darüberhinaus polymorph, d.h. es gibt abhängig von Temperatur und Druck
unterschiedliche Strukturen.
Ein wichtiges Beispiel ist das Eisen mit den folgenden temperaturabhängigen
Phasenumwandlungen:
α-Fe (b.c.c.) ⟶ oberhalb 910 oC ⟶ γ-Fe (f.c.c.)
⟶ 1390 oC ⟶ δ-Fe (b.c.c.)
Die beiden dichtesten Kugelpackungen sind in mehrfacher Hinsicht
für die gesamte Strukturchemie wichtig, denn:
- Fast alle Metalle kristallisieren in einem der drei obengenannten Strukturtypen.
- In den meisten Legierungen (d.h. Verbindungen der Metalle untereinander!)
treten dieselben Baumuster auf, wobei es entweder zu geordneter oder
ungeordneter/statistischer Substitution der Atompositionen kommt
(s. hierzu Kap. 3.2. Substitutionsmischkristalle
aus der Vorlesung Intermetallische Phasen.
- In den Strukturen der meisten Ionenkristalle bildet die größere Atomsorte
(d.h. meist die Anionen) eine analoge Teilstruktur aus. Daher ist die
Analyse der Packung in Hinblick auf die vorhandenen Lücken nützlich auch
zum Verständnis
die Strukturchemie der Salze.
An dieser Stelle aber zuerst zu einfachen Varianten dieser drei
Metallstrukturtypen.
Stapelvarianten (Polytype)
Neben den einfachen Stapelvarianten AB (h.c.p.) und ABC (f.c.c.) werden bei
Elementen auch andere Stapelfolgen beobachtet. Diese sind in Tabelle
3.2.2. mit der Jagodzinski-Nomenklatur (h/c: hexagonale/kubische Stapelfolge) zusammengestellt.
| Zahl der Schichten |
Stapelfolge |
Jagodzinski- Symbol |
Beispiel |
| 2 |
|:AB:| |
h |
Mg-Typ |
| 3 |
|:ABC:| |
c |
Cu-Typ |
| 4 |
|:ABAC:| |
hc |
La, Pr, Nd, Pm |
| 5 |
|:ABCBC:| |
hhccc |
|
| 6 |
|:ABCACB:| |
hcc |
|
| 9 |
|:ABABCBCAC:| |
hhc |
Sm |
Tab. 3.2.2. Stapelvarianten dichtester Packungen
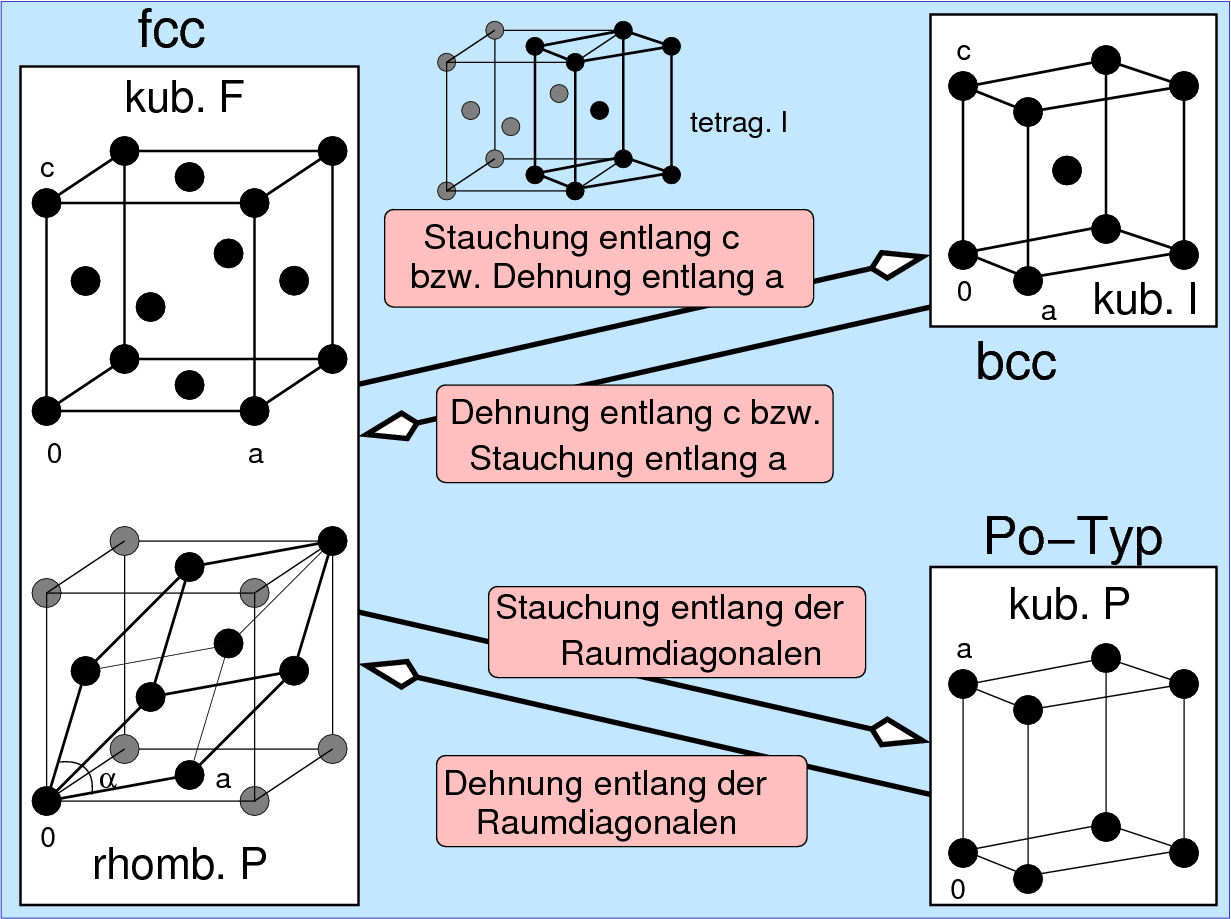
Verzerrungsvarianten
Neben Stapelvarianten gibt es einige metallische Elemente, die
als Verzerrungsvarianten der einfachen Strukturtypen kristallisieren:
- Verzerrungsvarianten der hexagonal-dichten Kugelpackung (h.c.p.):
- hexagonale Verzerrung (Änderung des c/a-Verhältnisses)
- Eine hexagonal dichte Kugelpackung mit vergrößertem c/a-Verhältnis liegt z.B. für
Zn, Cd vor, wo das c/a-Verhältnis von normalweise 1.63 auf ca. 1.9
vergrößert ist. Dadurch weist jedes Atom sechs nähere Nachbarn innerhalb der Schicht
und sechs weiter entferntere Nachbarn zu benachbarten Schichten auf
(Werte für Zn: 6 * 265.9 pm und 6 * 290.6 pm). Diese Strukturen
sind als dichte Packung von gestreckten Ellipsoiden ('Eier') zu verstehen.
- Hexagonal dichteste Kugelpackung mit verkleinertem c/a-Verhältnis finden sich bei
den Elementstrukturen von Y, Ho, Er und Tm (c/a ca. 1.57).
- Verzerrungsvarianten der kubisch innenzentrierte Packung (b.c.c.):
Bei den verzerrten Varianten der b.c.c.-Packungen ergeben sich zwei wichtige
Verzerrungsrichtungen:
- tetragonale Verzerrung (Dehnung oder Stauchung von a)
- Verzerrungsvarianten der kubisch-flächenzentrierten Packung:
- tetragonale Verzerrung (Dehnung oder Stauchung von a)
- f.c.c. mit verkleinertem c/a-Verhältnis s.o.
- rhomboedrische Verzerrung (Dehnung oder Stauchung entlang der Raumdiagonalen)
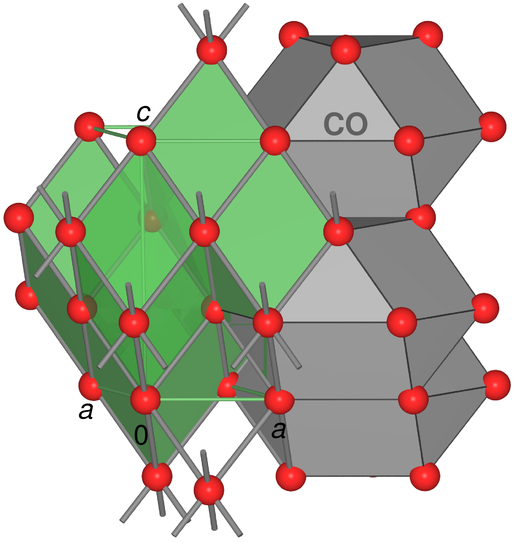
- f.c.c. mit gestauchter Raumdiagonale: Diese Art
der Verzerrung bildet den Übergang der f.c.c.-Packung zum
kubisch primitiven α-Po-Typ (s. Abb. 3.2.3.).
In der Rhomboeder-Aufstellung der kubisch dichten
Kugelpackung liegt der Rhomboederwinkel bei 60o,
im Hg beträgt er 70.5o (s. Abb. 3.2.4.) und für α-Po geht er
schließlich auf 90o auf.
Abb. 2.4.2. Struktur von elementarem Quecksilber
(grün: Elementarzellen des verzerrter Po-Typ;
grau: Kuboktaeder (CO) als Koordinationspolyeder
der gestauchten f.c.c.-Struktur)
- Video ... (aus der Strukturchemievorlesung vom WS 2021)
| ... zur Martensit-Umwandlung und zu den Strukturen von In und Hg
(79MB|MP4|H264) |
|
Besondere Strukturen
Die meisten B1-Metalle und einige der A2-Elemente bilden besondere
Strukturen, die den Übergang zu den kovalent gebauten B2-Elementen bilden:
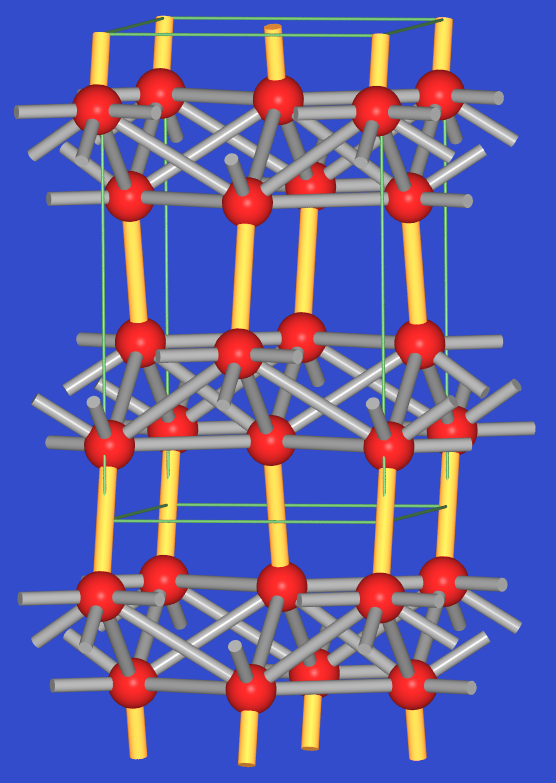
- Die α-Form (Tieftemperatur-Form unterhalb 13oC) von Zinn kristallisiert in der
Diamantstruktur, ist also ein typisches kovalentes, vierbindiges Element der 4. Hauptgruppe.
In der β-Form, dem sogenannten weißen
oder metallischen Zinn, sind die Sn-Atome von vier, in Form eines flachen Tetraeders (4 * 302
pm, in Abb. 3.2.5. fette Stäbe) angeordneten Nachbarn koordiniert.
Zwei weitere Nachbarn (dünne Stäbe) befinden sich über den
aufgeweiteten Kanten (2 * 318 pm). Mit einer Gesamtkoordinationszahl von 6 besteht
also wieder eine direkte Verwandtschaft mit dem α-Po-Typ.
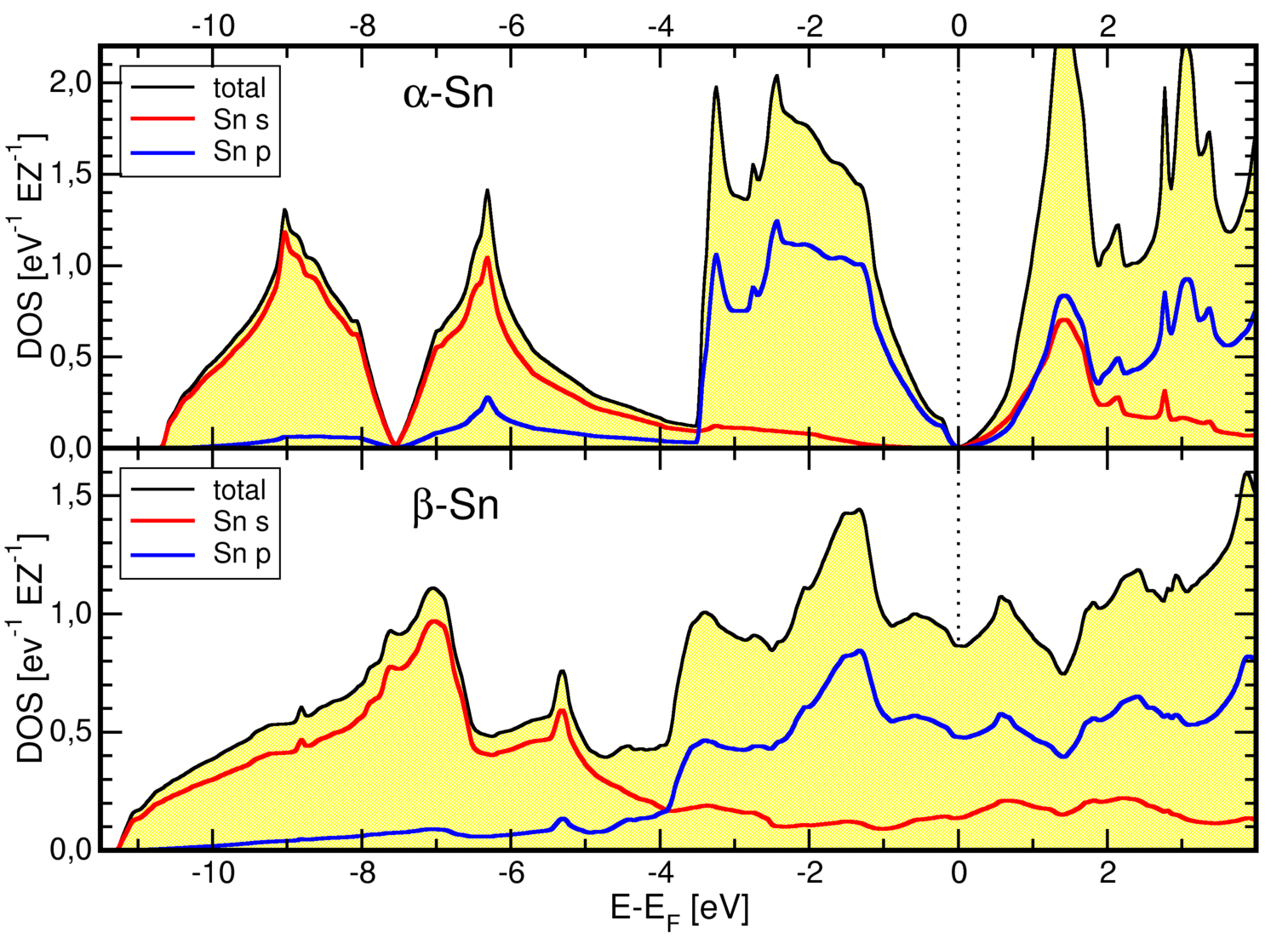
Abb. 3.2.5. Struktur von metallischem Zinn (links)
‣VRML
und Vergleich der berechneten Zustandsdichten von α- und β-Zinn (rechts)
Die Abbildung 3.2.5 rechts zeigt die berechneten Zustandsdichten von α- und β-Zinn.
Aus ihr wird sofort sichtbar, dass graues α-Zinn (Diamantstruktur) einfache kovalente
Bindung zeigt (vgl. Silicium, Germanium usw.: Vierbindigkeit, (Pseudo)Bandlücke),
während die metallische β-Form ein typisches Metall ist (hohe Zustandsdichte am Ferminiveau).
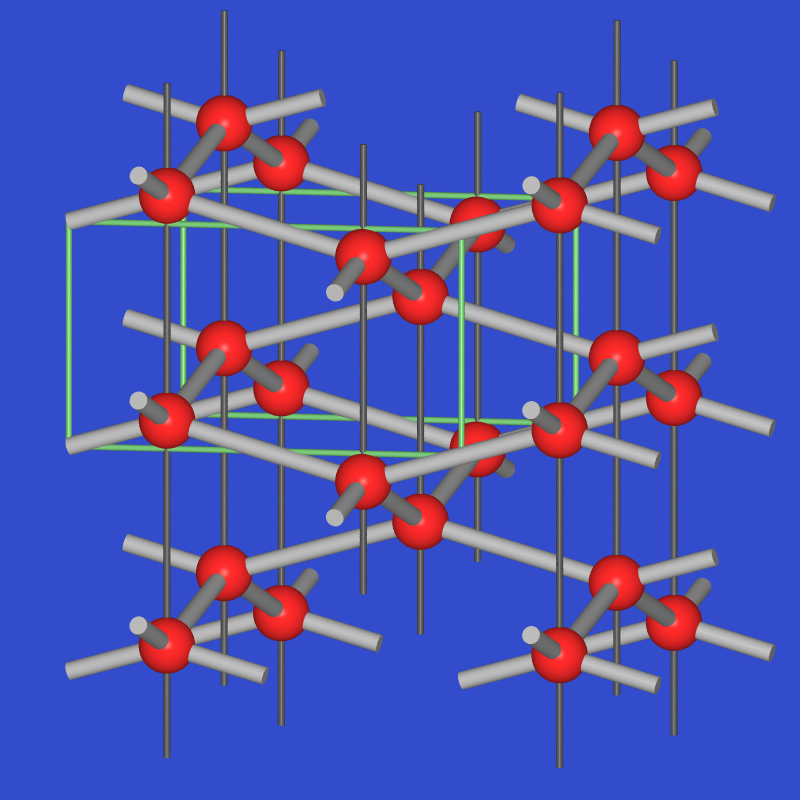
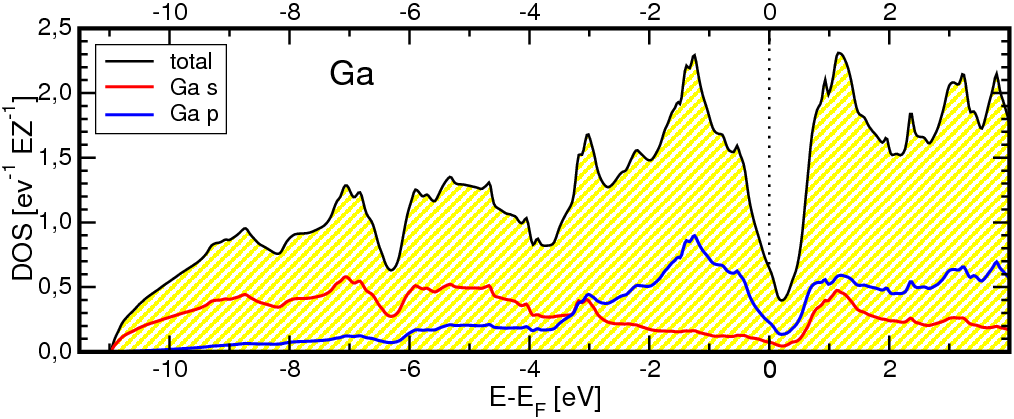
- In der Normaltemperaturform von Gallium
liegen Hanteln vor (1*247 pm, gelbe Bindungen in Abb. 3.2.6. links). Weitere sechs
Ga-Nachbarn sind in Abständen von 270 bis 280 pm (grau) angeordnet.
Die Hanteln sind nicht nur im Festkörper ausgebildet, sondern konnten auch in der Schmelze
nachgewiesen werden. Die Zustandsdichte (Abb. 3.2.6 rechts) zeigt mit der sehr deutlichen Pseudobandlücke
wie beim α-Zinn die Bedeutung kovalenter Bindungsanteile (hier, da elektronenarm, Cluster!)
an.
Abb. 3.2.6. Struktur von metallischem Gallium (links)
‣VRML
und berechneten Zustandsdichten (rechts)
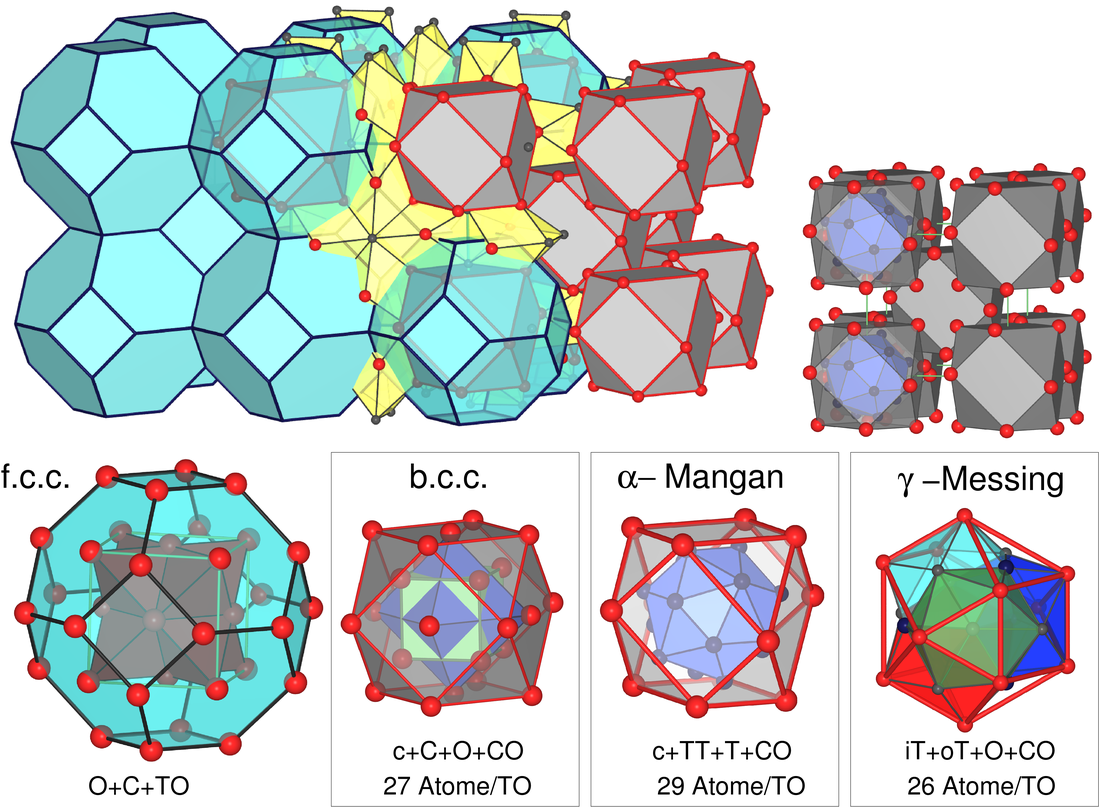
- Mangan kristallisiert in mehreren komplizierten Strukturen mit
Koordinationszahlen der Mn-Atome von 12 bis 16. α-Mn ist kubisch, Raumgruppe I4̅3m, mit
58 (2x29, s.u.) Atomen (4 kristallographische Lagen) in der Elementarzelle.
Die komplexe Struktur lässt sich relativ einfach erklären, wenn man wie beim
γ-Messing (s. Kapitel 4.2.
der Vorlesung Intermetallische Phasen) vorgeht und
kuboktaedrische Ausschnitte aus dichten Kugelpackungen betrachtet.
Die Kuboktaeder (12 Atome) sind innenzentriet angeordnet (wie beim b.c.c.- und
bei γ-Messing-Typ) und mit einem zentrierte FK-16-Polyeder (1+16 Atome) gefüllt.
Abb. 3.2.7. Zerlegung einfacher
Metallpackungen zur Erklärung der Strukturen von
α-Mn und γ-Messing
β-Mn, die Hochtemperaturform, ist ebenfalls kubisch. Die Struktur ist auch recht kompliziert
und wird im Kapitel 2.5. der Vorlesung
Intermetallischen Phasen im Detail besprochen.
γ-Mn kristallisiert im Wolfram-Typ (b.c.c.-Packung).
- Die Actinoiden Uran, Neptunium und Plutonium bilden ebenfalls viele verschiedene
Modifikationen. Prinzip der Strukturen sind hier dichteste Schichten in der
Ebene, die aber nicht über die Zwickel, sondern über die Kanten der
Dreiecke gestapelt sind.
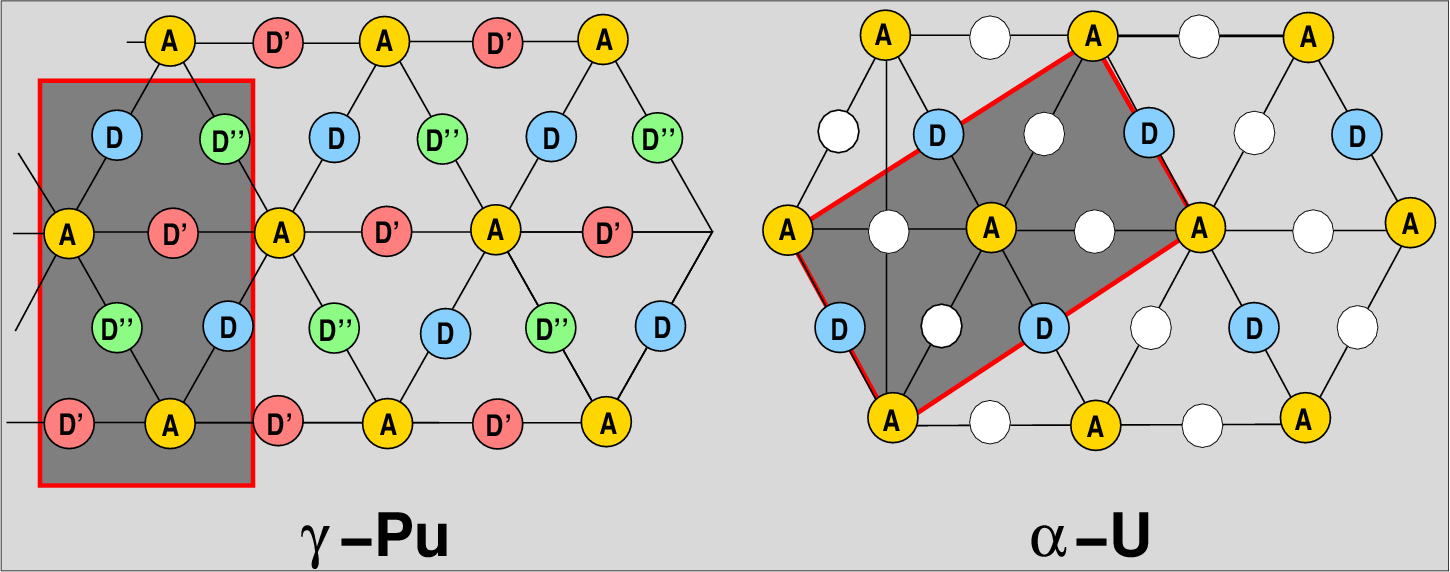
Abb. 3.2.8. Uran und Plutonium-Typ
‣SVG
In Abbildung 3.2.8. sind Projektionen der γ-Pu-Struktur und des
α-U-Typs gezeigt. Statt der A-B-C-Bezeichnung verwendet man hier zur
Unterscheidung von den dichten Packungen auch die Bezeichnungen |:ADD'D'':| bzw. |:AD:|.